Temps de lecture : 15 minutes | Publié le 22/09/2020 | Jean (INCI Beauty)
L'aluminium est très utilisé dans les cosmétiques sous forme de sels. Mais de quoi s'agit-il exactement ? Les controverses les concernant sont-elles réellement justifiées ? Et leurs utilisations dans nos produits du quotidien pourraient-elle présenter des risques pour notre santé ou notre planète ?
La fabrication de l'aluminium
L’aluminium est le 3ème élément le plus abondant de la croute terrestre (8%), 13ème élément du tableau périodique symbolisé par « Al ». C'est un métal assez réactif seul, c’est la raison pour laquelle on le retrouve dans la nature principalement sous forme oxydée ou complexée par d’autres éléments. L’aluminium présente l’avantage d’être infiniment recyclable, néanmoins il n’est recyclé en France qu'à hauteur de 32%, dans ce cas, on parle d’aluminium secondaire.
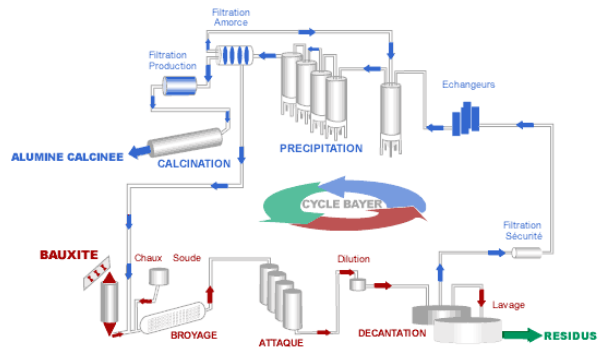
L’aluminium primaire est produit grâce au procédé Bayer, à partir de bauxite, une roche caractérisée par sa forte teneur en alumine Al2O3 (oxyde d’aluminium) et en oxyde de fer, ce qui lui confère sa couleur rouge.
(c) Energies renouvelables Environnement
Les 5 étapes de la fabrication de l'aluminium sont les suivantes :
- Le broyage de la bauxite en fines particules pour faciliter l'extraction (on augmente la surface de contact pour la réaction suivante)
- L'attaque des particules par de la soude et de la chaux dans des réacteurs à haute température et haute pression. Cette attaque est nécessaire car dans la bauxite les éléments contenant le fer et l’aluminium sont mélangés. Pour procéder à leur séparation, on agit sur le pH qui peut influencer la forme physique d’un composé. Un composé soluble dans l’eau peut devenir par exemple non soluble si les conditions de pH varient. Dans le cas de la Bauxite, pour séparer les espèces ferriques des espèces contenant de l’aluminium, on joue sur le pH afin de les isoler en deux phases différentes.
En fixant un pH supérieur à 10, on obtient alors Al(OH)4-, qui reste en suspension dans la phase liquide, et le fer lui, reste sous sa forme solide Fe(OH)3. - La décantation dans des clarificateurs de la phase solide (Riche en oxyde de fer) que l’on sépare de la phase liquide, riche en ions aluminium. Les résidus sont lavés plusieurs fois et forment les "boues rouges" couleur due à leur forte concentration en oxyde de fer.
- Lors de la précipitation la phase liquide est refroidie et diluée pour faire précipiter l'aluminium sous forme d'hydrate d'alumine (Al(OH)3).
- Pendant la calcination, l'alumine est chauffée à plus de 1000°C pour être déshydratée selon la réaction suivante :
2Al(OH)3=Al2O3 + 3H2O
Lors de ce procédé des résidus extrêmement toxiques sont produits et présentent un fort danger environnemental du fait de leur teneur en métaux lourds (comme l’arsenic ou le mercure) mais aussi en raison de leur pH très basique.
![]() Située dans le parc national des Calanques, l'usine ALTEO rejetait jusqu’en 2015 ses boues rouges dans la Mer Méditerranée. Depuis, sous la pression de l'Etat, un nouveau procédé a dû être développé permettant de les transformer en tuiles solides. Néanmoins, ce nouveau processus ne serait pas très écologique non plus, puisqu'il rejetterait dans l’atmosphère une multitude de poussières fines chargées en polluants nocifs et radioactifs.
Située dans le parc national des Calanques, l'usine ALTEO rejetait jusqu’en 2015 ses boues rouges dans la Mer Méditerranée. Depuis, sous la pression de l'Etat, un nouveau procédé a dû être développé permettant de les transformer en tuiles solides. Néanmoins, ce nouveau processus ne serait pas très écologique non plus, puisqu'il rejetterait dans l’atmosphère une multitude de poussières fines chargées en polluants nocifs et radioactifs.
De l’aluminium sous forme utile (sels)
En cosmétique l’aluminium n’est quasiment jamais utilisé sous sa forme métallique, mais la plupart du temps sous forme de sel. Néanmoins, sa forme métallique peut être exploitée pour les emballages et les contenants.
![]() En chimie, un sel désigne un édifice "neutre" formé de l’association de cations (ions positifs) et d'anions (ions négatifs). Ces ions peuvent être minéraux ou organiques. En français, le nom d'un sel commence par celui de l'anion (chlorure, acétate ...) suivi de celui du cation (sodium, ammonium ...). En anglais, c'est l'inverse. Par exemple, le sel de table est composé de Chlorure de sodium en français (Sodium Chloride en anglais).
En chimie, un sel désigne un édifice "neutre" formé de l’association de cations (ions positifs) et d'anions (ions négatifs). Ces ions peuvent être minéraux ou organiques. En français, le nom d'un sel commence par celui de l'anion (chlorure, acétate ...) suivi de celui du cation (sodium, ammonium ...). En anglais, c'est l'inverse. Par exemple, le sel de table est composé de Chlorure de sodium en français (Sodium Chloride en anglais).
L’ion naturel de l’aluminium est le cation Al3+ , il s’agit donc pour fabriquer un sel d’aluminium, de l’associer à un anion pour faire en sorte que la somme des charges devienne neutre. Les halogènes (Chlore, Brome) qui sont composés naturellement de charges négatives sont de bons candidats.
La formation des sels d’aluminium peut se faire directement à partir de l’alumine ou encore à partir de l’aluminium métallique. Par exemple pour la fabrication de l’aluminium chloride, il existe deux possibilités de synthèse :
- A partir d’alumine : Al2O3 + 6 HCl → 2 AlCl3 + H2O
- A partir de l’aluminium métallique : 2 Al + 6 HCl → 2 AlCl3 + 3H2
Formes, propriétés et utilisation de l'aluminium
L’aluminium intervient dans la formulation d’une grande partie des produits cosmétiques et n’est pas toujours exploité pour les mêmes propriétés.
Dans les crèmes solaires, il est utilisé comme agent de texture grâce à l’action combinée avec le dioxyde de titane. Les hydroxydes d’aluminium (considérés comme inertes vis-à-vis de la peau) servent à l’enrobage des particules de titane de manière à les rendre stables et pour qu'elles ne pénètrent pas la peau.
Dans les anti-transpirants, les sels d’aluminium sont utilisés en tant que déodorant et astringent. Ce dernier attribut n'est pas dû à des propriétés chimiques mais à une capacité physique qui lui permet de bloquer les pores de la peau. En effet, la précipitation des sels d'aluminium permet en association avec les peaux mortes de créer un véritable bouchon qui empêche les glandes sudoripares de sécréter de la transpiration. Par ailleurs, les sels d'aluminium ont des propriétés anti-odeurs puisque ce sont des bactéricides. Les odeurs sont en effet créées par le métabolisme et composées de différentes bactéries qui digèrent les peaux mortes présentes dans les aisselles. En éliminant ces bactéries, on prévient donc le dégagement de mauvaises odeurs.
![]() Les sels d'aluminium (hydroxyde d'aluminium, phosphate d’aluminium, et sulfate de potassium et d'aluminium) sont utilisés comme adjuvants dans certains vaccins, afin d’améliorer la réponse immunitaire. Une fois le vaccin injecté à une personne à l’aide d’une seringue, ces adjuvants servent à « retenir » les antigènes (les composants actifs du vaccin) au point d'injection et à y attirer les cellules du système immunitaire pour améliorer l’efficacité du vaccin.
Les sels d'aluminium (hydroxyde d'aluminium, phosphate d’aluminium, et sulfate de potassium et d'aluminium) sont utilisés comme adjuvants dans certains vaccins, afin d’améliorer la réponse immunitaire. Une fois le vaccin injecté à une personne à l’aide d’une seringue, ces adjuvants servent à « retenir » les antigènes (les composants actifs du vaccin) au point d'injection et à y attirer les cellules du système immunitaire pour améliorer l’efficacité du vaccin.
L’aluminium est aussi présent dans l’agroalimentaire sous la dénomination E520 (Sulfate d’aluminium) et est utilisé en tant qu’agent de texture (Il est utilisé dans de nombreuses préparations : soupes, pates, charcuterie, sauces, confiseries, desserts…).
Activité sur l’organisme
L’aluminium est suspecté d’être capable d’altérer le génome des êtres vivants, de cela découlent plusieurs suspicions et recherches mettant en lien ces sels avec le cancer du sein ou certaines maladies neurologiques. Sa dangerosité vient de sa capacité à s’accumuler à des endroits spécifiques de notre corps.
L’aluminium peut s’introduire dans le corps de deux façons :
- par voie orale
- par voie cutanée, ce mode d'introduction est principalement rempli par les sels d’aluminium. Notez qu'une peau abimée ou lésée, peut créer des microfissures et rendre ce passage encore plus facile.
Selon L’autorité européenne de sécurité des aliments (EFSA), en dessous de 1 mg d’aluminium hebdomadaire par Kg corporel, ce dernier est inoffensif : cet apport est couvert en grande partie par l’alimentation.
Alimentation
L’apport en aluminium dans le corps est essentiellement dû aux aliments qui comportent des additifs de type E520. A cela, il faut ajouter l’aluminium qui peut s’introduire du fait d'utilisation d’ustensiles qui en contiennent ou encore d'interactions qui peuvent avoir lieu entre contenus et contenants (canettes, conserves…). Son élimination est principalement rénale.
L’EFSA , dans son rapport de 2008, considère que « la base de données sur la cancérogenèse des composés aluminiques est limitée. Dans l’étude la plus récente, rien n’a indiqué un quelconque potentiel cancérogène chez des souris ayant reçu du sulfate d’aluminium et de potassium ajouté à fortes doses dans l’alimentation. Globalement, le groupe scientifique a conclu qu’il est improbable que l’aluminium soit cancérogène chez l’Homme aux doses alimentaires pertinentes » (EFSA , 2008).
Chez l’Homme, l’aluminium circule essentiellement sous la forme d’ion Al3+ dans le sang grâce à la transferrine, à des taux dont les niveaux augmentent avec l’âge, mais également dans le squelette (la moitié de la charge), les poumons (le quart de la charge), la peau, le tractus gastro-intestinal, les ganglions lymphatiques, les glandes surrénales, les glandes parathyroïdes. Sous sa forme libre, il peut former des complexes avec des acides, des amino-acides, des nucléotides ou des macromolécules.
Aérosols
Les produits en spray contenant de l’aluminium sont facilement absorbés par inhalation. Les particules pourraient dans ce cas, directement se loger dans le cerveau.
Application cutanée
Durant ses dernières années, les scientifiques ont noté une nette hausse des ventes d’anti-transpirants, un âge précoce d’apparition de cancers chez les utilisateurs de ces déodorants, une action de l’aluminium sur les cellules tumorales mammaires, ainsi qu'une localisation de ces tumeurs très proches des sites d’application des produits.
Néanmoins, à ce jour, aucune corrélation n’a pu être établie entre sel d'aluminium et cancer. Les études montrent que cet aspect est plus compliqué à étudier. Selon un rapport de l’ANSM publié en 2019, les études menées jusqu'à présent ne sont pas concluantes : "les données existantes ne permettent pas d’établir un faisceau d’arguments en faveur d’un lien de causalité entre aluminium et cancer du sein", mais elles "ne permettent pas de l’exclure définitivement". De plus aux USA, l’Institut national du cancer aux États-Unis (2008) a tiré des conclusions proches : les données trop peu nombreuses et les études discutables méthodologiquement ne permettent pas d’aboutir à un lien de causalité clair. Aucun élément n’est actuellement suffisant pour qualifier l’aluminium de cancérogène. Aucune norme ne fixe donc un taux maximum autorisé.
En 2016, lors d’une étude Suisse, le professeur et oncologue André-Pascal Sappino et le docteur Stefano Mandriota ont injecté des cellules exposées aux sels d’aluminium (plus précisément AlCl3) sur des souris. Ils ont observé que cela engendrait « des tumeurs extrêmement agressives et de multiples métastases dans l’organisme ».
D’autres études ont mis en évidence les effets neurotoxiques de l'aluminium. Il jouerait également un rôle dans :
- Le développement du psoriasis
- L’intolérance au glucose
- Les insuffisances hépatorénales chroniques
- L’anémie
- L’apparition de la maladie d'Alzheimer.
L’absence de données viables n’empêche pas d’instaurer un principe de précaution vis-à-vis de l’aluminium. Ainsi plusieurs recommandations ont été instaurées : En 2014, le CSSC avait conclu que les études n’étaient pas assez fournies pour établir une dose maximale d’aluminium en cosmétique et a donc demandé aux industriels de lui fournir plus de données.
En mars 2020, le CSSC a donc réévalué ce risque et instauré plusieurs recommandations en matière de dosage :
- 6.25% dans les déodorants sans spray
- 10.60% dans les sprays
- 2.65% dans les dentifrices
- 0.77% dans les rouges à lèvres
Néanmoins, sachez que ces recommandations restent des indications qui ne donneront pas lieu à une modification de la réglementation.
L'ANSM quant à elle, recommande de ne pas dépasser une concentration de 0,6 % de sels d'aluminium dans les produits cosmétiques.
Pourquoi certains sels sont-ils irritants ou dangereux ?
Comment pénètrent-ils ?
Les sels d’aluminium ont une forte facilité à passer les pores de la peau et encore plus si celle-ci est lésée, en effet ces sels ont la particularité d’être très solubles dans l’eau. Par exemple, le chlorhydrate d’aluminium (s=500g/L) une fois solvaté va libérer des ions Cl- OH- et Al3+. Les ions Al3+ peuvent donc pénétrer via les pores et voyager à travers les fluides corporels pour se loger dans différentes parties du corps. Ils peuvent aussi pénétrer par le biais des voies respiratoires en raison des produits sous forme de sprays.
Pourquoi irritent-ils ?
Pour comprendre pourquoi certains sels sont irritants, il faut s’intéresser aux équations chimiques :
La forme anhydre de AlCl3 est un composé très réactif avec l’eau aboutissant à la production de HCl (produit de la réaction entre H2O et AlCl3). La réaction étant exothermique et HCl un acide fort, AlCl3 devient un composé irritant et corrosif.
La forme hexahydrate-AlCl3 est moins corrosive. En présence d’eau, ce composé s’ionise en Al(H2O)6(3+) et trois ions Cl-. Le cation Al(H2O)6(3+) est un acide faible, ce qui le rend corrosif, car en milieu physiologique il donne AlOH4- et AlOH3 le tout accompagné par une production de l’acide fort HCl.
Les formes chlorohydrate d’aluminium et sesquichlorohydrate, dont la formule générale est du type Alx(OH)y(Cl)z sont des composés moins corrosifs car déjà partiellement hydrolysés. Néanmoins elles peuvent aussi s’hydrolyser dans l’eau avec production d’HCl.
Les alternatives
L’alternative la plus sûre serait de se passer totalement des composés à base d’aluminium. Ainsi, on peut désormais acheter des déodorants à base de magnésium, de carbonate d’acide de sodium, de carbonate de zinc, de talc, de perlite ou de substances issues de pierres volcaniques qui ont des propriétés absorbantes mais aussi anti-odeurs.
On trouve aussi des déodorants à base de plantes comme la sauge qui est un anti-odeur et régule la sudation. L’alcool peut aussi être un bon candidat pour lutter contre les bactéries, mais il peut être irritant.
Depuis quelques années, les déodorants à base de pierre d’alun ont le vent en poupe. La pierre d'alun est un minéral naturel qui peut aussi être synthétisé. Néanmoins, bien qu'elle soit naturelle, elle contient tout de même de l’aluminium. Elle possède des propriétés astringentes, et anti-odeurs tout comme ses homologues chimiques. Au contact avec l’eau, elle libère des hydroxydes d’aluminium considérés comme inertes. Elle pourrait être une alternative viable aux sels conventionnels dans les déodorants, mais avant tout il faudrait démontrer clairement que ces derniers sont réellement nocifs et que la pierre d’alun n’est pas plus dangereuse que ceux-ci.
Les sels d'aluminium sur INCI Beauty
Suite à la publication de ce dossier, nous avons choisi de faire évoluer certaines fleurs de couleurs liées aux dérivés d'aluminium. Les sels d'aluminium à destination des anti-transpirants restent en rouge, en raison du principe de précaution. Les sels d'aluminium autorisés par Cosmos (cahier des charges européen certifiant les produits Bio) restent dans leur couleur actuelle. Les autres sels d'aluminium passent en orange du fait de leur transformation. Le potassium Alum (Pierre d'Alun), reste mis en orange pour marquer le fait qu'il s'agit lui aussi d'un sel d'aluminium, avec les risques que cela pourrait comporter dans le cadre d'une utilisation sous les aisselles.
Ci-dessous, les dérivés d'aluminium les plus utilisés en cosmétique :
| Nom | Fleur actuelle | Changement |
| ALUMINUM HYDROXIDE Cosmos : Oui |
 |
|
| ALUMINA Cosmos : Oui |
 |
|
| CALCIUM ALUMINUM BOROSILICATE Cosmos : Oui |
 |
|
| ALUMINUM STARCH OCTENYLSUCCINATE |  |
 |
| MAGNESIUM ALUMINUM SILICATE Cosmos : oui |
 |
|
| POTASSIUM ALUM |  |
|
| ALUMINUM CHLOROHYDRATE |  |
|
| ALUMINUM CALCIUM SODIUM SILICATE |  |
 |
| ALUMINUM ZIRCONIUM TETRACHLOROHYDREX GLY |  |
|
| ALUMINUM STEARATE Cosmos : oui |
 |
|
| ALUMINUM SESQUICHLOROHYDRATE |  |
|
| ALUMINUM DIMYRISTATE |  |
 |
| SODIUM POTASSIUM ALUMINUM SILICATE |  |
 |
| ALUMINUM BENZOATE |  |
 |
| ALUMINUM/MAGNESIUM HYDROXIDE STEARATE |  |
 |
| REMERCIEMENTS : Ce dossier sur l'aluminium est issu de recherches effectuées par AUBEELUCKSING Prashansing, étudiant en 1ère annèe à l'école d'ingénieurs SIGMA Clermont, dans le cadre d'un stage de fin d'année chez INCI Beauty. Merci à lui pour les nombreuses informations récoltées. Merci à Sylvie DUCKI, professeure de Chimie organique à SIGMA, pour ses conseils avisés et son encadrement. |
Sources :
- Aluminium. In: Wikipédia. ; 2020.
- Bauxite. In: Wikipédia. ; 2019.
- Néphéline. In: Wikipédia. ; 2019.
- Pierre d’Alun naturelle | Potassium Alum.
- Sels-daluminium-Diego-2014.pdf.
- Propriété de l’aluminium : physique et mécanique. Aluminium France.
- Tout savoir sur l’aluminium | Techniques de l’Ingénieur | Techniques de l’Ingénieur.
- Le procédé Bayer | Energies Renouvelables et Environnement.
- L’industrie de l’alumine.
- Fabrication de l’aluminium : tout part de la bauxite…
- Une étape de l’élaboration de l’aluminium
- Gardanne : la colère monte d’un cran contre l’usine Alteo, une plainte contre X est déposée au pénal.
- Crème solaire, UV, FPS, nano : toutes les infos ! Boutique Bio.
- NAME C. Pourquoi y a-t-il de l’aluminium dans les vaccins ? | vaccination-info.
- TEST E520 Sulfate d'aluminium
- L’EFSA emet un Avis sur la Sécurité de l’Aluminium dans l’Alimentation. European Food Safety Authority. Published July 15, 2008.
- Evaluation du risque lié à l’utilisation de l’aluminium dans les produits cosmétiques - Point d’information - ANSM : Agence nationale de sécurité du médicament et des produits de santé.
- Mandriota SJ, Tenan M, Ferrari P, Sappino A-P. Aluminium chloride promotes tumorigenesis and metastasis in normal murine mammary gland epithelial cells. Int J Cancer. 2016;139(12):2781-2790. doi:10.1002/ijc.30393
- Willhite CC, Karyakina NA, Yokel RA, et al. Systematic review of potential health risks posed by pharmaceutical, occupational and consumer exposures to metallic and nanoscale aluminum, aluminum oxides, aluminum hydroxide and its soluble salts. Crit Rev Toxicol. 2014;44(Suppl 4):1-80. doi:10.3109/10408444.2014.934439



